PROUCTS LIST
中檢院發(fā)文:腸-肝類器官串聯(lián)共培養(yǎng)研究藥物吸收和毒性過程
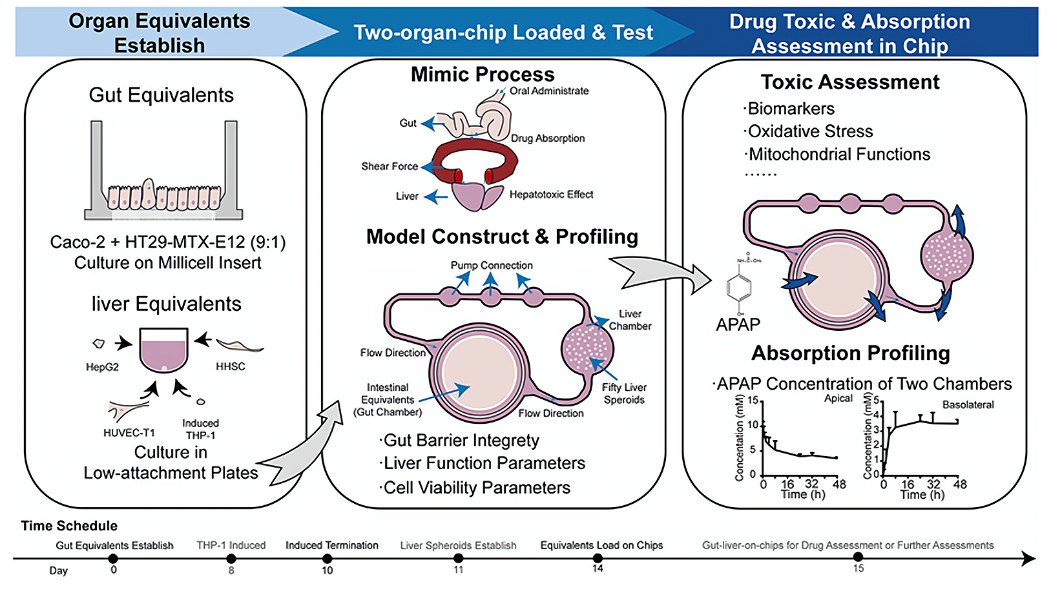
為了彌補(bǔ)動(dòng)物模型的局限性,提出了新的藥物安全性評(píng)估模型,以完善和減少現(xiàn)有的模型。為了在體外腸-肝臟的微生理系統(tǒng)(MPS)中模擬藥物的吸收和代謝,并預(yù)測藥代動(dòng)力學(xué)和毒性效應(yīng),中國食品藥品檢定研究院安全評(píng)價(jià)研究所(國家藥物安全評(píng)價(jià)監(jiān)測中心),中國醫(yī)學(xué)科學(xué)院 & 北京協(xié)和醫(yī)學(xué)院,德國TissUse GmbH公司的科學(xué)家一起合作,建立了一個(gè)腸-肝臟串聯(lián)培養(yǎng)芯片,檢測了APAP(對乙酰氨基酚)過量后的急性肝臟損傷過程,并于2024年9月發(fā)表于《Food and Chemical Toxicology》雜志。
使用 Caco-2 和 HT29-MTX-E12 細(xì)胞系建立了腸類器官,同時(shí)利用 HepG2、HUVEC-T1 和經(jīng) PMA 誘導(dǎo)的 THP-1 以及人類肝臟星狀細(xì)胞建立了肝臟類器官。使用高效液相色譜法測定 APAP 濃度,并使用 Phoenix 軟件通過非房室分析法擬合藥代動(dòng)力學(xué)參數(shù)。肝臟損傷生物標(biāo)志物天冬氨酸轉(zhuǎn)氨酶和丙氨酸轉(zhuǎn)氨酶的變化,以及肝臟功能標(biāo)志物白蛋白表明,這兩個(gè)器官芯片模型在 4 天內(nèi)的短期培養(yǎng)是穩(wěn)定的。在給藥對乙酰氨基酚(APAP)后,活性氧信號(hào)增強(qiáng),同時(shí)線粒體膜電位降低,caspase-3(半胱氨酸天冬氨酸蛋白酶-3)被激活,p53 信號(hào)增強(qiáng),表明 APAP 過量引發(fā)了毒性反應(yīng)。在腸肝臟多器官系統(tǒng)模型中,我們擬合了毒代動(dòng)力學(xué)參數(shù),并模擬了 APAP 過量后的肝臟毒性過程,這將有助于器官芯片在藥物毒性檢測中的應(yīng)用。
1. 引言
藥物性肝臟損傷(DILI)是藥物研發(fā)的主要障礙,會(huì)導(dǎo)致藥物撤市(2021 年;2016 年)。動(dòng)物模型與人體之間的差異以及日益嚴(yán)格的倫理要求,使得有必要采用新的藥物安全性評(píng)估模型(2014 年)。這種微生理系統(tǒng)(MPS),也稱為“芯片上的器官",是一種通過結(jié)合微流控、微制造和三維(3D)細(xì)胞培養(yǎng)構(gòu)建的裝置。它能夠?yàn)閯?dòng)物模型重現(xiàn)生理相關(guān)的器官功能。MPS平臺(tái)是一種微型化的體外生理環(huán)境(Shinohara等,2021)。
這使得能夠模擬和精確控制化學(xué)梯度和生物力學(xué)力,以模擬體內(nèi)環(huán)境并響應(yīng)。預(yù)定義的微流控通道充當(dāng)工程化的血管,重現(xiàn)體內(nèi)生理組織功能(Low 等,2020 年),并允許與其他多器官系統(tǒng)聯(lián)合(Kulthong 等,2020 年)。此外,多器官系統(tǒng)能夠?qū)崿F(xiàn)實(shí)時(shí)組織功能監(jiān)測(Milani 等,2022 年)。
由微流道串聯(lián)的多器官芯片模型能夠進(jìn)一步模擬人類動(dòng)態(tài)反應(yīng)和內(nèi)部器官相互作用(Arakawa 等,2020 年),并為藥物暴露與藥物效果/毒性的關(guān)系提供輔助證據(jù)。腸和肝臟是主要的吸收、分布、代謝和排泄(ADME)器官,因此在藥代動(dòng)力學(xué)(PK)研究中非常重要(Vernetti 等,2017 年)。
口服藥物通過消化道和腸直接吸收進(jìn)入血液,影響藥物的生物利用度和全身劑量。腸芯片模型可以模擬藥物吸收,并描繪藥物的 ADME 和血藥濃度(Milani 等,2022 年)。Lee 等(2017 年)建立了一個(gè)三維腸肝臟芯片來描繪對乙酰氨基酚(APAP)的藥代動(dòng)力學(xué)模型,而 Arakawa 等(2020 年)構(gòu)建了一個(gè)腸-肝臟模型,用于SAN唑侖的連續(xù)代謝的體外定量推算。Milani 等(2022 年)評(píng)估了由于腸和肝臟對麥考酚酯代謝而產(chǎn)生的藥物前體麥考酚酯的量。因此,類似的方法可以應(yīng)用于其他多器官的 MPS,以研究人體內(nèi)的藥效學(xué)過程。
目前僅有少數(shù)關(guān)于同時(shí)進(jìn)行毒性檢測和樣本鑒定的多器官芯片系統(tǒng)的例子被報(bào)道。Liu等(2020 年)基于基于腸、血管、肝臟和腎臟芯片的多器官芯片系統(tǒng)研究了人參皂苷復(fù)合物 K 的吸收、代謝和毒性。Jeon等(2021 年)報(bào)道了一種腸肝臟芯片,重現(xiàn)了脂肪酸的吸收以及隨后在肝臟中的脂質(zhì)積累。
為了探索體外腸-肝臟的微生理系統(tǒng),在此,我們通過將腸培養(yǎng)物與使用四種細(xì)胞系構(gòu)建的 3D 肝臟球體串聯(lián)在二聯(lián)器官芯片(2OC)上,開發(fā)了一種可重復(fù)的腸-肝臟的二聯(lián)器官芯片。我們通過檢測功能生物標(biāo)志物和蛋白質(zhì)的水平來剖析芯片功能,然后在芯片中通過向腸腔室添加肝臟毒性化合物對乙酰氨基酚(APAP)來測試肝臟毒性,以模擬藥物吸收后的肝臟毒性。經(jīng)過 48 小時(shí)的孵育,檢測了兩個(gè)腔室中的藥物分布和肝臟毒性信號(hào)。
2. 材料和方法
2.1. 細(xì)胞與培養(yǎng) 細(xì)胞資源及培養(yǎng)方法見補(bǔ)充信息。
2.2. 腸的培養(yǎng)
為了在 Transwell 培養(yǎng)板上構(gòu)建腸模型,以 1 ×10-6 細(xì)胞/孔的密度將 Caco-2 細(xì)胞接種到 Transwell 培養(yǎng)板(默克公司,PIHP01250)中。將 Caco-2 和 HT29-MTX-E12 細(xì)胞以 9:1 的比例混合,并以相同的濃度接種到每個(gè)培養(yǎng)板中。從第 0 天到第 7 天,每兩天更換一次培養(yǎng)基,第 7 天之后每天更換一次。
2.3. 3D(肝臟)的培養(yǎng)
基于我們之前的研究(Sun 等,2024 年),THP-1 細(xì)胞在 RPMI 1640 培養(yǎng)基中稀釋至 5 ×10-5 細(xì)胞/毫升,然后用 25 納摩爾的佛波酯酰基乙酸(PMA,MedChemExpress)處理 48 小時(shí),在 6 孔板中進(jìn)行。隨后在培養(yǎng)基中培養(yǎng) 24 小時(shí)并用 TryplE(Gibco)進(jìn)行篩選,經(jīng) PMA 誘導(dǎo)的 THP-1 細(xì)胞被收集。 2 HepG2、人臍靜脈內(nèi)皮細(xì)胞 T1、THP-1 以及人類肝臟星狀細(xì)胞(HHSC)消化后收集,細(xì)胞懸液以 60:19:15:6 的比例混合。為了形成等量細(xì)胞,稀釋后每孔接種 100 個(gè)細(xì)胞到圓底 U 型低貼壁 96 孔板(深圳肝臟生物技術(shù)有限公司,LV-ULA002-96UW)中。每兩天更換一半培養(yǎng)基。 使用高內(nèi)涵細(xì)胞成像分析儀(珀金埃爾默公司,Opretta 系列)對球形形態(tài)進(jìn)行了觀察和測量。
2.4. 基于芯片的腸-肝臟共培養(yǎng)
HUMIMIC Chip2 24 孔板(德國 TissUse GmbH)是按照推薦方案(Wagner 等,2013 年)制備的。在腸模型建立后的第 14 天,將 Transwell 細(xì)胞嵌體添加到 24 孔培養(yǎng)室中,并將 50 個(gè)球體添加到 96 孔培養(yǎng)室中,以形成腸-肝臟芯片模型。
根據(jù)之前的方法(Lin 等,2020 年),在2OC 微流道循環(huán)中,使用600 ul循環(huán)培養(yǎng)基和 400 ul位于屏障頂部的培養(yǎng)基中進(jìn)行共培養(yǎng)。
肝臟腔室中的培養(yǎng)基每天更換一次,并且收集并更換一半的循環(huán)上清液。在 7 天共培養(yǎng)結(jié)束時(shí),使用免疫熒光法分析肝臟的器官特異性功能標(biāo)志物。將片上微流泵設(shè)置為 0.8 Hz的頻率。
2.5. 腸類器官的完整性
在不同時(shí)間點(diǎn)測量熒光素鈉和 40 kDa熒光異硫氰酸熒光素 - 葡聚糖的跨內(nèi)皮電阻(TEER)和腸表觀通透性系數(shù)(Papp),以評(píng)估腸類器官的完整性。方法見補(bǔ)充信息。
2.6. 肝臟類器官的性能評(píng)估
在肝臟模型中,選擇了一種靈敏的雙色熒光細(xì)胞活力測定法來區(qū)分活細(xì)胞和死細(xì)胞。使用鈣黃綠熒光素 AM(一種細(xì)胞可滲透染料)作為活細(xì)胞指示物,使用碘化 BOBO-3(Invitrogen 公司)作為死細(xì)胞指示物。活細(xì)胞成分在活細(xì)胞中產(chǎn)生強(qiáng)烈、均勻的綠色熒光(激發(fā)/發(fā)射 488 納米/515 納米),而死細(xì)胞成分主要產(chǎn)生細(xì)胞核紅色熒光(激發(fā)/發(fā)射 570 納米/602 納米)。 在使用建立的肝臟器官芯片模型獲得的上清液中測量了各種生物標(biāo)志物。我們評(píng)估了白蛋白(ALB)、尿素(UREA)、天冬氨酸轉(zhuǎn)氨酶(AST)和丙氨酸轉(zhuǎn)氨酶(ALT)的水平,這些是肝臟代謝和損傷的指標(biāo)。根據(jù)制造商的說明,使用 Cell Titor Glo 3D(Promega)測量了三磷酸腺苷(ATP)的含量。 膽酰基-賴氨酸-熒光素(CLF)是一種熒光素標(biāo)記的膽汁酸,其生物學(xué)行為與天然膽酰基甘氨酸非常相似。為了在三維肝臟模型中可視化膽管,我們制備了 20 微摩爾的 CLF 儲(chǔ)備液,并將模型在 37°C 下孵育 2 小時(shí)。用 Hoechst 33342 染色并孵育 10 分鐘。細(xì)胞用無酚紅培養(yǎng)基沖洗三次,并在激發(fā)/發(fā)射波長為 498/517 納米處檢測熒光信號(hào)。
2.7. 形態(tài)學(xué)與免疫染色
如前所述(Sun 等,2024 年),腸和肝臟的等量切片用多聚甲醛固定,并用蔗糖溶液脫水。冷凍切片在染色前先用蘇木精-伊紅(HE)染色、高碘酸-希夫(PAS)染色或免疫染色進(jìn)行切割。對于免疫染色,切片先用 PBS 沖洗三次 用含有 0.5% Triton X-100(索爾博)的 PBS 處理細(xì)胞,處理時(shí)間及穿孔處理 10 分鐘,用山羊血清(Beyotime Biotechnology)封閉 30 分鐘,在室溫下進(jìn)行。按照說明書以一定稀釋度向每個(gè)孔中加入一抗原位體,并在 4℃下孵育過夜。使用以下一抗原位體:抗 Occludin(91131S,CST,1:400 稀釋度)、抗 ZO-1(ab221547,Abcam,1:100 稀釋度)、抗 MRP2(ab172630,Abcam,1:500 稀釋度)和抗 PGP(貨號(hào) 25081-2-AP,ProteinTech,1:500 稀釋度)。清洗細(xì)胞,用相應(yīng)的熒光偶聯(lián)二抗原位體處理,并與 DAPI(Beyotime Biotechnology)共定位。使用高內(nèi)涵細(xì)胞成像分析儀或顯微鏡(奧林巴斯 IX71)觀察明視野形態(tài)和切片。 對于原位免疫熒光染色,腸膜和 3D 肝臟模型用 PBS 沖洗三次,并用 4%多聚甲醛固定 30 分鐘。接下來,樣本在含有 0.5% Triton X-100(索爾博)的 PBS 中穿孔處理 10 分鐘,并在室溫下用山羊血清(Beyotime Biotechnology)封閉 30 分鐘。 按照說明書,將稀釋后的原位抗體以一定稀釋度加入每個(gè)孔中,并在4℃下孵育過夜。使用的原位抗體包括:抗Occludin(91131S,CST,1:400稀釋)、抗ZO-1(sc-33725,Santa Cruz Biotechnology,1:500稀釋)、抗MRP2(ab172630,Abcam,1:500稀釋)、抗ABCB11/BSEP(ab255605,Abcam,1:100稀釋)、抗PGP(Cat No. 25081-2-AP,ProteinTech,1:500稀釋)、抗CYP3A4(MA5-17064,ThermoFisher,1:1000稀釋)、抗Ki67(9449S,CST,1:10,000稀釋)、抗CD31(3528S,CST,1:100稀釋)、抗CD68(ab213363,Abcam,1:100稀釋)、抗SMA(14395-1-AP,ProteinTech,1:100稀釋)、抗裂解的caspase-3(9664S,CST,1:400稀釋)和抗p53(2524S,CST,1:2000稀釋)。細(xì)胞經(jīng)過洗滌,與熒光偶聯(lián)的次級(jí)抗體孵育,并與DAPI(Beyotime Biotechnology)共定位。使用的次級(jí)抗體包括:山羊抗兔IgG H&L(Alexa Fluor® 488)(ab150077,Abcam,1:1,000稀釋)、山羊抗鼠IgG(H + L)(Alexa Fluor® 555 Conjugate)(4417,CST,1:1000稀釋)和山羊抗小鼠IgG H&L(Alexa Fluor® 488)(ab150113,Abcam,1:1,000稀釋)。結(jié)果通過高含量分析和熒光顯微鏡進(jìn)行評(píng)估。
2.8. 藥物毒性和細(xì)胞活力測定
如前所述(Sun 等,2024 年),使用 Cell Titor Glo 檢測細(xì)胞活力,并測定細(xì)胞存活率和細(xì)胞存活率(%)。在 96 孔板中,以 1 ×10-4細(xì)胞/孔的密度將細(xì)胞接種到 96 孔板中;次日丟棄上清液,并與對乙酰氨基酚(4 毫摩爾)一起培養(yǎng)。使用同樣的方法測定球體的存活率。該檢測使用光度計(jì)進(jìn)行。
2.9. 阿司匹林在共培養(yǎng)芯片中的模擬口服過程
加載了 7 個(gè) 2OC 模型,其中 4 個(gè)微流道給藥對乙酰氨基酚(APAP),其余回路未給予。為了模擬口服過程以及 APAP 誘導(dǎo)的肝臟毒性后果,在加載 2OC 回路后的第二天,向插入物頂部加入 400 微升 10 毫摩爾的 APAP。在 0、0.5、1、2、4、8、24、32 和 48 小時(shí)分別收集 10 微升上清液用于液相色譜定量分析。在給藥 48 小時(shí)后,收集上清液用于各種生物標(biāo)志物的測量以評(píng)估透皮電阻(TEER)。同時(shí)收集肝臟球體用于肝臟毒性評(píng)估。我們還至少收集了 3 - 5 個(gè)用于細(xì)胞活力測定,其余部分轉(zhuǎn)移到 96 孔板中保存以用于熒光染色。
2.10. 共培養(yǎng)芯片的肝臟毒性評(píng)估
根據(jù)推薦的試劑盒方案,測量細(xì)胞活力以及白蛋白(ALB)、天冬氨酸氨基轉(zhuǎn)移酶(AST)和丙氨酸氨基轉(zhuǎn)移酶(ALT)水平,以評(píng)估藥物給藥 48 小時(shí)后的肝臟損傷情況。使用線粒體膜電位檢測試劑盒(Beyotime Biotechnology,C2001S)進(jìn)行測定線粒體膜電位。將 2OC 芯片的 3D 包埋肝臟模型轉(zhuǎn)移到 96 孔板中。分別在 Ex/Em = 550/575 和 350/461 納米檢測四甲基羅丹明乙酯(TMRE)和 Hoechst 33342 的熒光信號(hào)。使用 CellROX 氧化應(yīng)激試劑(賽默飛世爾科技,C10444)測定氧化應(yīng)激。 將 2OC 芯片的 3D 嵌入式肝臟模型轉(zhuǎn)移到 96 孔板中。分別在 485/520 納米和 350/461 納米檢測 CellROX 和 Hoechst 33342 的熒光信號(hào)。使用免疫熒光染色法檢測原位 Ki-67、裂解的 caspase-3 和 p53 信號(hào),以評(píng)估細(xì)胞增殖能力和細(xì)胞凋亡情況。
2.11. 樣本定量
基于之前的方法(Marin 等,2019 年),使用高效液相色譜法(HPLC)(島津,LC-2040C 3D)測量對乙酰氨基酚(APAP)的濃度。基底側(cè)腔室(肝臟腔室)用新鮮培養(yǎng)基填充,而頂側(cè)腔室暴露在對乙酰氨基酚培養(yǎng)基中。在每個(gè)時(shí)間點(diǎn),如第 2.9 節(jié)所述,從兩側(cè)各取 10 微升樣本。選擇甲醇作為蛋白質(zhì)沉淀劑,在加入 30 微升甲醇以沉淀蛋白質(zhì)后,通過離心機(jī)(13000 轉(zhuǎn)/分鐘,4℃,15 分鐘)去除沉淀物。使用惰性可持續(xù) C18(150 毫米長度,內(nèi)徑 4.6 毫米,粒徑 5 微米,島津)色譜柱。使用兩種流動(dòng)相:溶劑 A(甲醇)和溶劑 B(蒸餾水),流速為 0.8 毫升/分鐘。溶劑組成在 0 - 4 分鐘為 5% A,4.01 - 10 分鐘為 5 - 100% A,10.01 - 15 分鐘為 5% A。進(jìn)樣量為 10 微升,檢測使用光電二極管陣列(PDA)檢測器(波長 280 納米)。使用標(biāo)準(zhǔn)曲線測定對乙酰氨基酚的濃度。 藥代動(dòng)力學(xué)參數(shù)使用非房室模型(NCA)在 Phoenix WinNonlin(Certara,美國)中進(jìn)行擬合。采用線性梯形線性插值法作為計(jì)算方法,模型類型定義為血漿,劑量選項(xiàng)定義為血管外。通過高效液相色譜法測定的肝臟隔室中的對乙酰氨基酚(APAP)濃度 - 時(shí)間數(shù)據(jù)進(jìn)行擬合,以確定 0 至 48 小時(shí)下的曲線下面積(AUC)。峰值濃度(Cmax)和達(dá)峰時(shí)間(Tmax)直接從個(gè)體濃度與時(shí)間曲線中讀取(高等,2022 年;王等,2022 年)。 采用超高效液相色譜 - 串聯(lián)質(zhì)譜法(UPLC-MS)檢測 NAPQI 的信號(hào)(張等,2018 年)。通過將 N-乙酰基對苯二酚亞胺(NAPQI)(MCE,HY-66005)溶解在甲醇中制備濃度為 1 毫克/毫升的儲(chǔ)備溶液,并用甲醇進(jìn)一步稀釋至 1 微克/毫升的工作溶液。對 NAPQI 的形成進(jìn)行了分析。 在服用對乙酰氨基酚(APAP)后 0.5、1、2、4、8、24、32 和 48 小時(shí),使用配備 AB SCIEX LC AC 系統(tǒng)、PDA 檢測器和三重四極桿 6600+儀器的超高效液相色譜 - 質(zhì)譜法(UPLC-MS)進(jìn)行檢測。通過使用沃特斯 ACQUITY UPLC BEH C18 色譜柱(2.1 毫米×50 毫米)實(shí)現(xiàn)了色譜分離。 1.7 微米)。使用的洗脫液為(A)0.1%(體積比)的甲酸水溶液和(B)甲醇,采用梯度洗脫程序進(jìn)行分離,如表S1所示。超高效液相色譜流速為0.3 mL/min,超高效液相色譜-質(zhì)譜分析使用10 微升樣品。對應(yīng)于解聚電位、碰撞能量、碰撞能量分布和溫度的離子對特征為m/z 149.98-108.04(30、30、15和350),對應(yīng)于NAPQI。
2.12. 統(tǒng)計(jì)分析
連續(xù)變量以均值±偏差(標(biāo)準(zhǔn)差)表示。采用雙尾學(xué)生 t 檢驗(yàn)來研究兩個(gè)獨(dú)立樣本之間的差異。數(shù)據(jù)分析使用 IBM SPSS Statistics 25 版(IBM 公司)進(jìn)行。線性回歸模型使用 SPSS 和 GraphPad Prism 7.00(GraphPad 軟件)進(jìn)行。統(tǒng)計(jì)學(xué)意義設(shè)定為 P≤0.05。
3. 結(jié)果
3.1. 類器官的培養(yǎng)
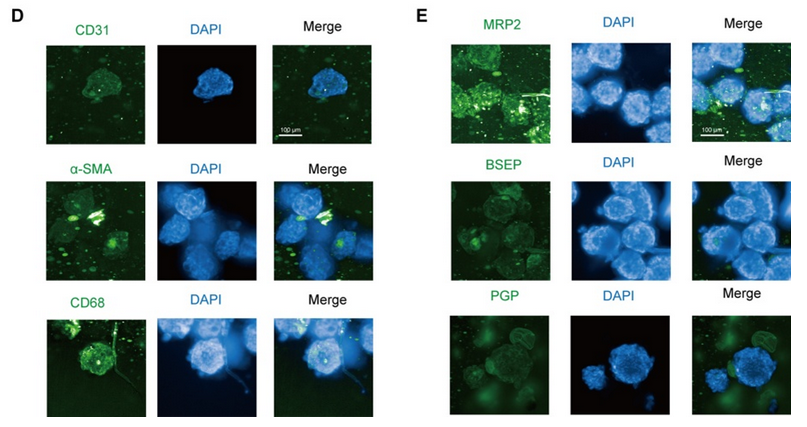
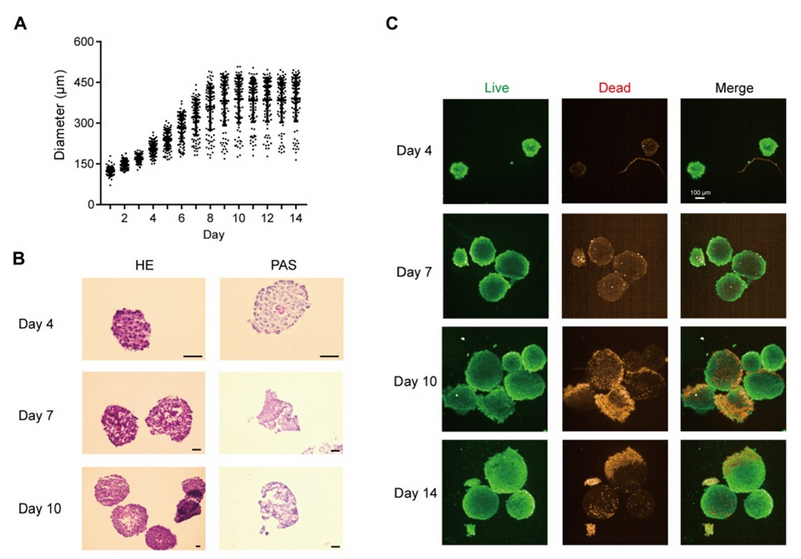
將細(xì)胞混合物以 1 ×10-6、5 ×10-5 和 2.5 ×10-5 個(gè)細(xì)胞/孔的密度接種到 Transwell 培養(yǎng)板中,以獲得體外腸模型。所有組的跨上皮電阻(TEER)在 21 天內(nèi)均達(dá)到 300 Ω cm2,其中高密度共培養(yǎng)組在 12 天內(nèi)達(dá)到 300 Ω cm2(圖 1A)。在第 14 天,高密度共培養(yǎng)組模型中熒光素鈉和熒光素葡聚糖均符合滲透性測試要求(圖 1B)。當(dāng)跨上皮電阻達(dá)到 200 - 1000 Ω cm2 時(shí),Caco - 2 單層可被視為完整(Iftikhar 等,2020 年)。在后續(xù)實(shí)驗(yàn)中,選擇高密度共培養(yǎng)組來形成腸屏障。 緊密連接蛋白 Occludin 和 ZO-1 經(jīng)過染色,以顯示其在腸等值物培養(yǎng)條件下的完整性。在第 7 天和第 21 天,我們觀察到 Occludin 的連續(xù)網(wǎng)絡(luò)結(jié)構(gòu)(圖 1C),而在第 14 天和第 21 天的切片中,Occludin 和 ZO-1 呈網(wǎng)狀結(jié)構(gòu)(圖 1D,圖 S1A),表明在第 14 天腸屏障被視為完整的。在第 14 天和第 21 天,轉(zhuǎn)運(yùn)蛋白 MRP2 和 PGP 分布在腸切片的一側(cè)(圖 1E,圖 S1B),表明腸模型的極性。總體而言,結(jié)果表明在第 14 天獲得的腸等值物具有緊密連接和極性;因此,在第 14 天腸屏障被視為成熟的,并用于進(jìn)一步的實(shí)驗(yàn)。 在圖 2A 中,模型的直徑在 10 天內(nèi)迅速增大,并穩(wěn)定在約 400 微米。HE 染色顯示在第 7 天(圖 2B)沒有明顯的壞死核心,但在第 10 天(圖 2B)有輕度壞死核心或幾個(gè)細(xì)胞凋亡,在第 14 天(圖 S1I)有嚴(yán)重的中心壞死區(qū)域。與活/死細(xì)胞染色(圖 2C)所示的死細(xì)胞分布一致,在第 10 天檢測到更多的死細(xì)胞。模型中 ATP 的總量持續(xù)增加(圖 S1C),而乳酸脫氫酶(LDH)的分泌沒有顯著增加(圖 S1D)。模型穩(wěn)定生長,隨著培養(yǎng)時(shí)間的延長,壞死細(xì)胞數(shù)量增加,通過檢測上清液中的 LDH 水平無法檢測到內(nèi)部壞死細(xì)胞。為避免壞死細(xì)胞核的形成,這些結(jié)果表明培養(yǎng)時(shí)間限制為 7 天。 在第 7 天(圖 2D)和第 10 天,分別通過 CD31、CD68 和α-SMA 信號(hào)來追蹤人臍靜脈內(nèi)皮細(xì)胞 T1(HUVEC-T1)、人肺泡巨噬細(xì)胞 THP-1 和人肝臟星狀細(xì)胞 HHSC 的熒光信號(hào),采用免疫熒光染色法進(jìn)行追蹤。
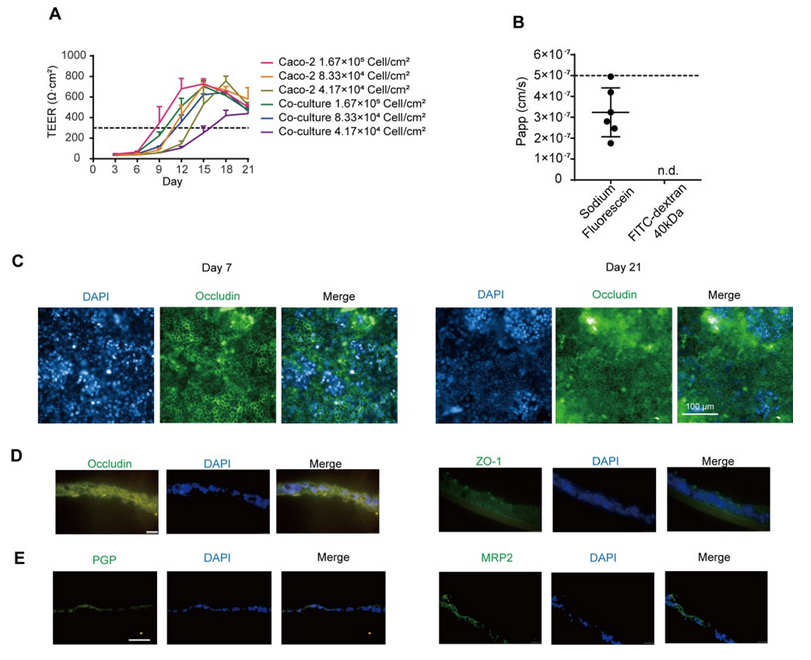
圖 S1G 表明,上述三種細(xì)胞類型在第 10 天仍存在于球體中。在第 7 天檢測了轉(zhuǎn)運(yùn)蛋白 MRP2、PGP 和 BSEP(圖 2E),并通過熒光探針 CLF 追蹤了膽汁酸外排的功能(圖 S1H)。CLF 是 MRP2 和 BSEP 的底物(Boaglio 等,2010 年),CLF 信號(hào)也表明了這些轉(zhuǎn)運(yùn)蛋白在類器官中的功能。 最后,PAS 染色顯示有糖原沉積(圖 2B),ALB 和 UREA 的增加趨勢表明,即使在細(xì)胞死亡緊急情況下,肝臟的總合成代謝功能也未受阻礙(圖 S1E - F)。這些結(jié)果表明,在 14 天內(nèi),類器官對肝臟功能的影響相對穩(wěn)定。
111