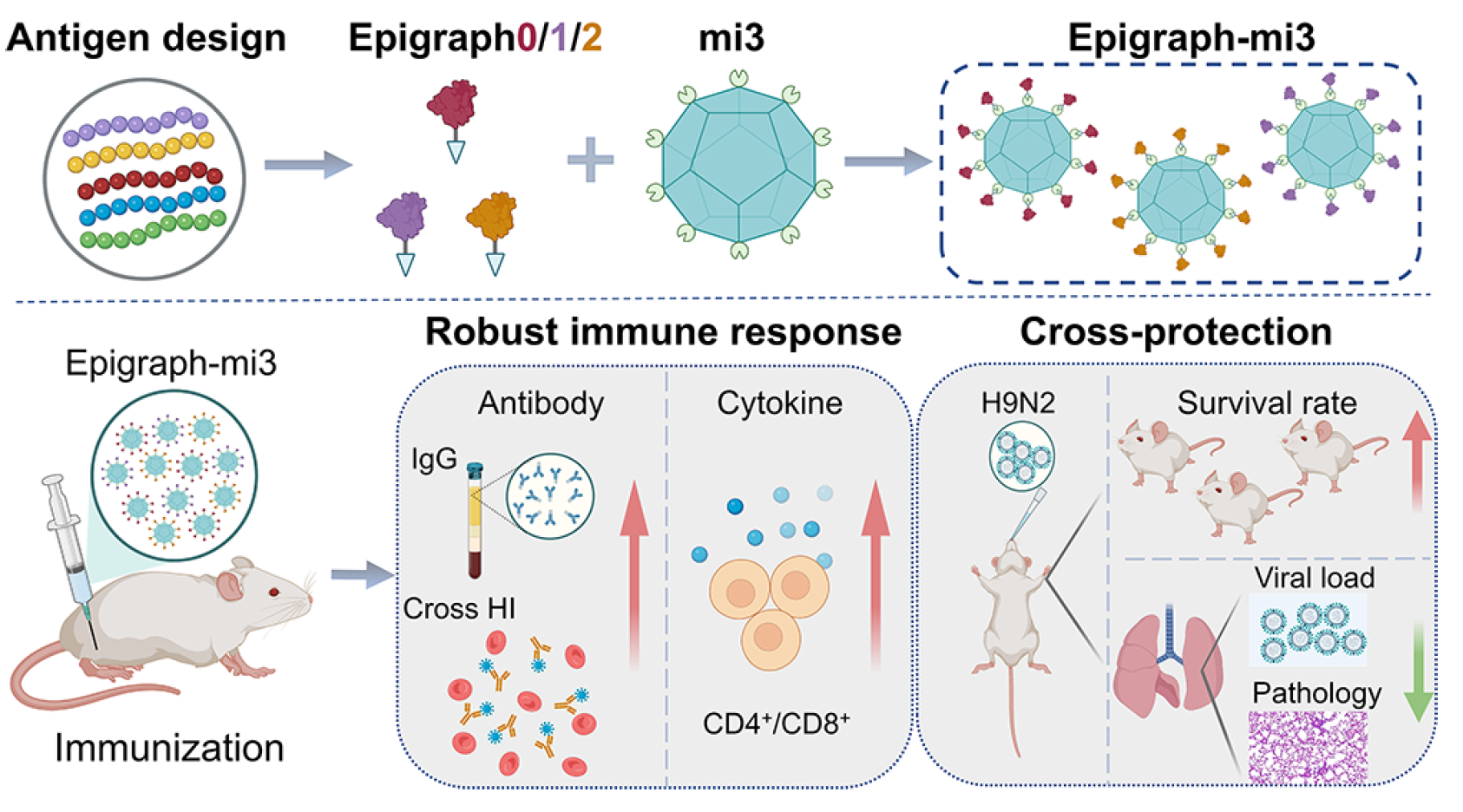
H9N2流感病毒通用疫苗研究取得進展
2025年6月份,中國科學院武漢病毒研究所科研團隊在《ACS Nano》期刊發表了題為“Epitope-Optimized Influenza Hemagglutinin Nanoparticle Vaccine Provides Broad Cross-Reactive Immunity against H9N2 Influenza Virus"的研究論文。該研究成功開發出一種針對H9N2流感病毒的表位優化型納米顆粒疫苗,在動物模型中展現出對多種H9N2毒株的廣譜交叉免疫保護效力,為全球 H9N2 流感疫情的防控提供了創新性解決方案。
摘要
H9N2病毒(AIV)對全球家禽業構成日益嚴重的威脅,并持續存在感染人類的風險。疫苗接種是預防和控制H9N2 AIV的關鍵策略。然而,病毒的持續進化不斷挑戰免疫保護的效率。因此,開發一種能夠引發廣譜免疫反應的通用H9N2流感疫苗對于疫情防控至關重要。本研究報道了一種表位優化的納米顆粒(NPs)疫苗,該疫苗能夠引發針對H9N2流感病毒的廣泛交叉反應性免疫。利用計算算法Epigraph,我們首先設計了三個具有優化表位的H9血凝素(HA1)球狀頭部。隨后,每個抗原與mi3 NPs結合,并將這三種構建體以等摩爾比例混合,生成Epigraph疫苗。我們將Epigraph疫苗與目前推薦的候選疫苗病毒(CVV)AL/39進行了比較。Epigraph疫苗在小鼠中有效誘導了交叉反應性抗體,并激活了CD4+和CD8+ T細胞免疫反應。此外,該疫苗對多種H9N2毒株的致死性攻擊提供了有效保護,并顯著降低了小鼠肺部的病毒載量。本研究為應對未來H9N2疫情提供了一種有前景的通用疫苗候選方案。
介紹
H9N2亞型病毒(AIV)于1966年從美國威斯康星州的火雞中分離,現已在歐亞大陸、中東和非洲國家的多種家禽中形成地方性流行,對全球家禽業造成嚴重經濟損失,并在哺乳動物和人類中引發零星感染。自1994年在中國分離以來,經過20多年的傳播與進化,H9N2已取代H7N9和H5N6病毒,成為中國禽類中的主要AIV亞型。目前,H9N2無需適應性突變即可直接感染人類,引發不同程度的呼吸道疾病。自1998年報告人類感染H9N2病例以來,2014年至2016年間,中國部分省份職業暴露人群的H9N2 AIV血清陽性率已達11.20%,表明禽類從業人員感染H9N2的風險顯著增加。
此外,自2020年以來,人類感染H9N2的病例數量顯著上升。截至目前,已有超過150人感染H9N2 AIV。系統發育分析表明,H9N2病毒是人類H5N1、H7N9、H3N8和H10N8病毒內部基因的供體,凸顯了其在新型流感病毒株出現中的關鍵作用。
近期研究表明,大多數H9N2病毒已獲得與人類型受體(α2,6唾液酸)結合的能力,這凸顯了采取有效措施預防和控制H9N2傳播的緊迫性。開發針對潛在大流行亞型的疫苗是大流行防控的關鍵策略。迄今為止,已開發出多種H9N2候選疫苗。然而,中國的H9N2病毒經歷了廣泛的基因重配,導致新基因型的不斷出現。這種持續的抗原變異顯著促進了病毒在免疫禽類中的傳播。盡管市售H9N2疫苗對匹配抗原的毒株普遍有效,但其對不匹配抗原毒株的保護效力有限。例如,1997年至2002年間分離的大多數H9N病毒與代表性疫苗株SD/6/96相比,表現出抗原漂移。疫苗株與流行株之間的不匹配使得有效控制H9N2病毒的傳播更加復雜,凸顯了改進疫苗技術并產生針對多種H9N2流感病毒的廣泛交叉免疫的迫切需求。
Epigraph是一種高效的基于圖的算法,通過所有潛在9聚體T細胞表位的覆蓋范圍來設計疫苗抗原。該算法已應用于開發治療性HIV疫苗候選物和泛絲狀病毒疫苗候選物。在小鼠和豬模型中,使用Epigraph算法設計的流感病毒候選疫苗表現出優于市售全滅活四價豬流感疫苗的交叉免疫反應。使用Epigraph算法設計的腺病毒載體疫苗已顯示出對豬H3亞型流感病毒的強保護性免疫反應。此外,計算設計的多價Epigraph血凝素疫苗在小鼠模型中表現出對乙型流感病毒的保護效力。該算法能夠高效計算設計單抗原或多抗原疫苗,病原體群體的潛在表位覆蓋范圍,并適用于包括疫苗開發在內的抗原設計項目。
血凝素(HA)蛋白是流感病毒表面暴露的糖蛋白,是自然和疫苗介導的甲型流感病毒免疫中免疫原性的靶點。HA通過結合細胞表面受體并誘導膜融合啟動感染,同時也是抗流感藥物的主要靶點。位于HA蛋白球狀頭部的受體結合域已被確定為疫苗接種后引發有效中和抗體的關鍵。盡管在開發基于HA的疫苗方面做出了諸多努力,但亞單位疫苗的低免疫原性仍然是一個限制因素。為克服這一限制,已使用多種類型的納米顆粒(NPs)通過多價抗原呈遞增強流感亞單位疫苗的免疫原性,包括病毒樣顆粒(VLPs)、噬菌體、多糖和病毒體。例如,計算設計并優化的突變體i3?01(mi3)已被用作納米級支架以增強抗原免疫原性。
抗原與納米顆粒的偶聯可通過自發連接的SpyTag-SpyCatcher蛋白質共價鍵合策略實現。該系統展現出顯著的連接效率和穩定性。在本研究中,我們將三個表位優化的HA1蛋白通過SpyTag共價連接到經SpyCatcher修飾的納米顆粒上,使目標蛋白能夠輕松附著于納米顆粒表面。通過將三種納米顆粒混合,我們設計了一種Epigraph疫苗候選物。動物實驗表明,該Epigraph疫苗能夠誘導高效且廣泛的體液和細胞免疫反應,并對不同H9N2病毒株的致死性攻擊提供充分保護。本研究支持Epigraph疫苗作為通用型H9N2流感疫苗的潛在候選物。
近期研究表明,大多數H9N2病毒已獲得與人類型受體(α2,6唾液酸)結合的能力,這凸顯了采取有效措施預防和控制H9N2傳播的緊迫性。開發針對潛在大流行亞型的疫苗是大流行防控的關鍵策略。迄今為止,已開發出多種H9N2候選疫苗。然而,中國的H9N2病毒經歷了廣泛的基因重配,導致新基因型的不斷出現。這種持續的抗原變異顯著促進了病毒在免疫禽類中的傳播。盡管市售H9N2疫苗對匹配抗原的毒株普遍有效,但其對不匹配抗原毒株的保護效力有限。例如,1997年至2002年間分離的大多數H9N2病毒與代表性疫苗株SD/6/96相比,表現出抗原漂移。疫苗株與流行株之間的不匹配使得有效控制H9N2病毒的傳播更加復雜,凸顯了改進疫苗技術并產生針對多種H9N2流感病毒的廣泛交叉免疫的迫切需求。
Epigraph是一種高效的基于圖的算法,通過所有潛在9聚體T細胞表位的覆蓋范圍來設計疫苗抗原。該算法已應用于開發治療性HIV疫苗候選物和泛絲狀病毒疫苗候選物。在小鼠和豬模型中,使用Epigraph算法設計的流感病毒候選疫苗表現出優于市售全滅活四價豬流感疫苗的交叉免疫反應。使用Epigraph算法設計的腺病毒載體疫苗已顯示出對豬H3亞型流感病毒的強保護性免疫反應。此外,計算設計的多價Epigraph血凝素疫苗在小鼠模型中表現出對乙型流感病毒的保護效力。該算法能夠高效計算設計單抗原或多抗原疫苗,不同病原體群體的潛在表位覆蓋范圍,并適用于包括疫苗開發在內的抗原設計項目。
血凝素(HA)蛋白是流感病毒表面暴露的糖蛋白,是自然和疫苗介導的甲型流感病毒免疫中免疫原性的靶點。HA通過結合細胞表面受體并誘導膜融合啟動感染,同時也是抗流感藥物的主要靶點。位于HA蛋白球狀頭部的受體結合域已被確定為疫苗接種后引發有效中和抗體的關鍵。盡管在開發基于HA的疫苗方面做出了諸多努力,但亞單位疫苗的低免疫原性仍然是一個限制因素。為克服這一限制,已使用多種類型的納米顆粒(NPs)通過多價抗原呈遞增強流感亞單位疫苗的免疫原性,包括病毒樣顆粒(VLPs)、噬菌體、多糖和病毒體。例如,計算設計并優化的突變體i3?01(mi3)已被用作納米級支架以增強抗原免疫原性。
抗原與納米顆粒的偶聯可通過自發連接的SpyTag-SpyCatcher蛋白質共價鍵合策略實現。該系統展現出顯著的連接效率和穩定性。在本研究中,我們將三個表位優化的HA1蛋白通過SpyTag共價連接到經SpyCatcher修飾的納米顆粒上,使目標蛋白能夠輕松附著于納米顆粒表面。通過將三種納米顆粒混合,我們設計了一種Epigraph疫苗候選物。動物實驗表明,該Epigraph疫苗能夠誘導高效且廣泛的體液和細胞免疫反應,并對不同H9N2病毒株的致死性攻擊提供充分保護。本研究支持Epigraph疫苗作為通用型H9N2流感疫苗的潛在候選物。
結果
H9表位抗原的設計與開發
H9表位抗原是使用Epigraph疫苗在線設計工具進行設計的,該工具采用了一種高效的基于圖的算法,通過將每個連續的抗原表位長度片段(即每個k-mer)視為潛在抗原表位,從而病原體群體的潛在表位覆蓋范圍。通常,k=9被設定為潛在T細胞表位(PTE)的長度,因為這是大多數細胞毒性T細胞I類表位的最佳長度。在抗原設計之前,我們從GISAID下載了截至2022年11月的所有可用H9N2 HA1序列。設計過程首先將數據集中的每個序列分解為所有可能的9-mer,并計算每個9-mer在樣本群體中的頻率值(覆蓋分數)。隨后,該算法從具有最高覆蓋分數的短序列(9-mer)中組裝出一組代表性蛋白序列(Epigraph0),確保該序列包含目標病毒群體中最常見的潛在9-mer表位。對于單價疫苗,單一抗原已足夠。然而,為了進一步提高覆蓋范圍,該算法去除由Epigraph0覆蓋的表位,并生成第二個互補序列(Epigraph1)。此過程重復進行以生成第三個互補序列(Epigraph2)。Epigraph0代表的單一抗原,Epigraph1是最佳互補抗原,依此類推。雖然增加Epigraph序列的數量可以提高群體覆蓋范圍,但隨著越來越罕見的表位被納入,收益逐漸遞減。最終的三價Epigraph免疫原(由Epigraph0、Epigraph1和Epigraph2抗原混合而成)為群體中的潛在線性表位提供了覆蓋。
為了可視化三個Epigraph序列與整個群體之間的關系,我們使用MAFFT將序列與來自流感研究數據庫的6,445個H9 HA1蛋白序列進行比對,并構建了最大似然(ML)系統發育樹(圖1A)。通過BLAST比對,我們在數據庫中識別出最相似的野生型序列如下:Epigraph0-A/雞/北京/XY1125/2014(序列一致性:99.7%),Epigraph1-A/雞/安徽/A3176/2014(序列一致性:90.21%),以及Epigraph2-A/雞/大阪/aq69/2001(序列一致性:90%)。為了評估Epigraph疫苗的效力,我們將其與當前推薦的候選疫苗病毒(CVV)A/安徽-廬江/39/2018(AL/39,2018年的人類分離株)進行了比較,該疫苗是世界衛生組織(WHO)于2018年推薦的候選滅活疫苗。
Production and Characterization of H9 Epigraph-mi3NPs
TH9 Epigraph-mi3納米顆粒的制備與表征。納米顆粒的尺寸對于激發免疫反應至關重要,其必須與病原體尺寸相當,才能被免疫細胞有效識別。因此,它們可作為載體,將抗原高效遞送至抗原呈遞細胞(APC),并誘導最佳的免疫激活反應。本研究采用mi3納米顆粒作為抗原展示的納米級支架,以提升免疫系統的激活效率。該支架是一種自組裝的多孔十二面體結構,由60個相同亞基構成,作為多聚化納米顆粒平臺,為免疫原性較弱的抗原提供安全且具有免疫原性的疫苗接種系統。
如先前所述,SpyTag是一種13個氨基酸的肽段,可在短時間內與其蛋白伴侶SpyCatcher(92個氨基酸)形成共價鍵(圖1B)。SpyCatcher/SpyTag系統因其簡便性、快速性及實現體外蛋白質自組裝的能力而被廣泛應用于蛋白質偶聯。因此,我們將SpyCatcher融合至mi3的N端(圖1C)。如圖1D、E所示,SpyCatcher-mi3在大腸桿菌細胞質中可溶且高效表達,并通過鎳柱親和層析及尺寸排阻色譜(SEC)進行純化。十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE)分析顯示,SpyCatcher-mi3納米顆粒呈現單一清晰條帶,SEC色譜圖中觀察到單一主峰,表明其結構均一且純度較高。負染透射電子顯微鏡(TEM)顯示,SpyCatcher-mi3組裝成預期的十二面體球形顆粒,直徑約為26 nm,略小于動態光散射(DLS)測得的流體力學直徑(圖1F、G)。為評估mi3納米顆粒的穩定性,我們進行了SDS-PAGE分析。將mi3納米顆粒在37、25、4及?80 °C下孵育1周,以評估其潛在降解情況。結果表明,mi3納米顆粒在所有測試溫度下均保持高度穩定(圖S1A),符合疫苗生產中納米顆粒支架的標準。
我們將SpyTag融合至密碼子優化的Epigraph HA基因的C端,將其克隆至pCAGGS載體中,并瞬時轉染HEK293F細胞,獲得Epigraph0-SpyTag、Epigraph1-SpyTag及Epigraph2-SpyTag抗原。SDS-PAGE分析顯示,三種Epigraph抗原均呈現單一清晰條帶,表明抗原純度較高(圖1D)。穩定性實驗表明,Epigraph抗原在37、25、4及?80 °C下孵育1周后仍保持穩定(圖S1A)。
我們將SpyTag融合到密碼子優化的Epigraph HA基因的C端,將其克隆到pCAGGS載體中,并通過瞬時轉染HEK293F細胞獲得了Epigraph0-SpyTag、Epigraph1-SpyTag和Epigraph2-SpyTag抗原。SDS-PAGE分析顯示,所有三種Epigraph抗原均呈現單一清晰的條帶,表明抗原純度較高(圖1D)。穩定性實驗表明,Epigraph抗原在37°C、25°C、4°C和?80°C下孵育1周后仍保持穩定(圖S1A)。
為制備Epigraph-mi3納米顆粒(NPs),我們首先評估了SpyCatcher-mi3與Epigraph-SpyTag在不同比例下的結合效率。結果顯示,隨著Epigraph-SpyTag量的增加,殘留的SpyCatcher-mi3逐漸減少。值得注意的是,當SpyCatcher-mi3與Epigraph-SpyTag的摩爾比達到1:4時,SpyCatcher-mi3的減少不再明顯,表明支架已達到飽和且存在過量的未結合Epigraph-SpyTag(圖S2)。基于這些發現,我們將15 μM的SpyCatcher-mi3與60 μM的Epigraph-SpyTag(mi3 NPs支架與Epigraph抗原的比例為1:4)在4°C下孵育過夜進行體外結合反應,隨后通過SEC純化去除未反應的Epigraph抗原和未結合的mi3 NPs。圖1D中的SDS-PAGE結果顯示,結合產物Epigraph-mi3呈現單一清晰的條帶,明顯大于Epigraph抗原和mi3,證實Epigraph抗原已有效結合到mi3 NPs上。這一結果在SEC色譜圖中Epigraph-mi3 NPs峰的前移中得到了進一步驗證(圖1E)。負染TEM顯示,mi3 NPs呈現規則形狀的球形顆粒,而Epigraph0-mi3 NPs表面模糊,可見明顯的突出蛋白,且直徑大于mi3 NPs。圖1F中Epigraph1-mi3和Epigraph2-mi3 NPs也觀察到類似結果。DLS分析證實了顆粒尺寸分布,Epigraph-mi3 NPs的流體動力學直徑大于未結合的mi3 NPs(圖1G)。
此外,所有 Epigraph-mi3 納米顆粒的多分散性指數(PDI)值均低于 0.5,表明 Epigraph-mi3 納米顆粒具有均勻的尺寸分布(表 S1)。
為了探究將 Epigraph 抗原偶聯到 mi3 納米顆粒上是否會影響其熱穩定性,我們將 Epigraph-mi3 納米顆粒分別在 37、25、4 和 -80 °C 下孵育 1 周。結果表明,在 -80 至 25 °C 的測試溫度范圍內,Epigraph-mi3 納米顆粒未出現顯著降解(圖 S1A)。差示掃描熒光法(DSF)結果顯示,Epigraph-mi3 納米顆粒和相應的 Epigraph 抗原表現出相似的熱穩定性,具有幾乎相同的 Tm 值,這表明 Epigraph 抗原與 mi3 蛋白的融合對其結構穩定性沒有顯著影響(圖 S1B)。由于大多數疫苗建議在冷藏條件下(2 - 8 °C)儲存,本研究構建的納米顆粒疫苗在常規疫苗儲存條件下保持了一定程度的熱穩定性。
Production and Characterization of H9 Epigraph-mi3NPs
TH9 Epigraph-mi3納米顆粒的制備與表征。納米顆粒的尺寸對于激發免疫反應至關重要,其必須與病原體尺寸相當,才能被免疫細胞有效識別。因此,它們可作為載體,將抗原高效遞送至抗原呈遞細胞(APC),并誘導最佳的免疫激活反應。本研究采用mi3納米顆粒作為抗原展示的納米級支架,以提升免疫系統的激活效率。該支架是一種自組裝的多孔十二面體結構,由60個相同亞基構成,作為多聚化納米顆粒平臺,為免疫原性較弱的抗原提供安全且具有免疫原性的疫苗接種系統。
如先前所述,SpyTag是一種13個氨基酸的肽段,可在短時間內與其蛋白伴侶SpyCatcher(92個氨基酸)形成共價鍵(圖1B)。SpyCatcher/SpyTag系統因其簡便性、快速性及實現體外蛋白質自組裝的能力而被廣泛應用于蛋白質偶聯。因此,我們將SpyCatcher融合至mi3的N端(圖1C)。如圖1D、E所示,SpyCatcher-mi3在大腸桿菌細胞質中可溶且高效表達,并通過鎳柱親和層析及尺寸排阻色譜(SEC)進行純化。十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE)分析顯示,SpyCatcher-mi3納米顆粒呈現單一清晰條帶,SEC色譜圖中觀察到單一主峰,表明其結構均一且純度較高。負染透射電子顯微鏡(TEM)顯示,SpyCatcher-mi3組裝成預期的十二面體球形顆粒,直徑約為26 nm,略小于動態光散射(DLS)測得的流體力學直徑(圖1F、G)。為評估mi3納米顆粒的穩定性,我們進行了SDS-PAGE分析。將mi3納米顆粒在37、25、4及?80 °C下孵育1周,以評估其潛在降解情況。結果表明,mi3納米顆粒在所有測試溫度下均保持高度穩定(圖S1A),符合疫苗生產中納米顆粒支架的標準。
我們將SpyTag融合至密碼子優化的Epigraph HA基因的C端,將其克隆至pCAGGS載體中,并瞬時轉染HEK293F細胞,獲得Epigraph0-SpyTag、Epigraph1-SpyTag及Epigraph2-SpyTag抗原。SDS-PAGE分析顯示,三種Epigraph抗原均呈現單一清晰條帶,表明抗原純度較高(圖1D)。穩定性實驗表明,Epigraph抗原在37、25、4及?80 °C下孵育1周后仍保持穩定(圖S1A)。
我們將SpyTag融合到密碼子優化的Epigraph HA基因的C端,將其克隆到pCAGGS載體中,并通過瞬時轉染HEK293F細胞獲得了Epigraph0-SpyTag、Epigraph1-SpyTag和Epigraph2-SpyTag抗原。SDS-PAGE分析顯示,所有三種Epigraph抗原均呈現單一清晰的條帶,表明抗原純度較高(圖1D)。穩定性實驗表明,Epigraph抗原在37°C、25°C、4°C和?80°C下孵育1周后仍保持穩定(圖S1A)。
為制備Epigraph-mi3納米顆粒(NPs),我們首先評估了SpyCatcher-mi3與Epigraph-SpyTag在不同比例下的結合效率。結果顯示,隨著Epigraph-SpyTag量的增加,殘留的SpyCatcher-mi3逐漸減少。值得注意的是,當SpyCatcher-mi3與Epigraph-SpyTag的摩爾比達到1:4時,SpyCatcher-mi3的減少不再明顯,表明支架已達到飽和且存在過量的未結合Epigraph-SpyTag(圖S2)。基于這些發現,我們將15 μM的SpyCatcher-mi3與60 μM的Epigraph-SpyTag(mi3 NPs支架與Epigraph抗原的比例為1:4)在4°C下孵育過夜進行體外結合反應,隨后通過SEC純化去除未反應的Epigraph抗原和未結合的mi3 NPs。圖1D中的SDS-PAGE結果顯示,結合產物Epigraph-mi3呈現單一清晰的條帶,明顯大于Epigraph抗原和mi3,證實Epigraph抗原已有效結合到mi3 NPs上。這一結果在SEC色譜圖中Epigraph-mi3 NPs峰的前移中得到了進一步驗證(圖1E)。負染TEM顯示,mi3 NPs呈現規則形狀的球形顆粒,而Epigraph0-mi3 NPs表面模糊,可見明顯的突出蛋白,且直徑大于mi3 NPs。圖1F中Epigraph1-mi3和Epigraph2-mi3 NPs也觀察到類似結果。DLS分析證實了顆粒尺寸分布,Epigraph-mi3 NPs的流體動力學直徑大于未結合的mi3 NPs(圖1G)。
此外,所有 Epigraph-mi3 納米顆粒的多分散性指數(PDI)值均低于 0.5,表明 Epigraph-mi3 納米顆粒具有均勻的尺寸分布(表 S1)。
為了探究將 Epigraph 抗原偶聯到 mi3 納米顆粒上是否會影響其熱穩定性,我們將 Epigraph-mi3 納米顆粒分別在 37、25、4 和 -80 °C 下孵育 1 周。結果表明,在 -80 至 25 °C 的測試溫度范圍內,Epigraph-mi3 納米顆粒未出現顯著降解(圖 S1A)。差示掃描熒光法(DSF)結果顯示,Epigraph-mi3 納米顆粒和相應的 Epigraph 抗原表現出相似的熱穩定性,具有幾乎相同的 Tm 值,這表明 Epigraph 抗原與 mi3 蛋白的融合對其結構穩定性沒有顯著影響(圖 S1B)。由于大多數疫苗建議在冷藏條件下(2 - 8 °C)儲存,本研究構建的納米顆粒疫苗在常規疫苗儲存條件下保持了一定程度的熱穩定性。
In Vitro Validation of the Antigenicity of Epigraph- mi3 NPs
為表征Epigraph-mi3納米顆粒的體外抗原性,我們評估了其凝集雞紅細胞的能力及其與商用H9N2血凝素(HA)抗體的結合動力學。實驗結果表明,Epigraph-mi3納米顆粒表現出與天然H9N2病毒粒子相當的凝集活性,在1 mg/mL濃度下凝集效價達到128,而mi3支架未顯示任何凝集活性(圖1H)。三種Epigraph蛋白和三種Epigraph-mi3納米顆粒均以劑量依賴性方式與商用HA抗體結合。值得注意的是,Epigraph-mi3納米顆粒的抗體結合親和力顯著高于可溶性Epigraph蛋白(圖1I)。綜上所述,這些體外實驗數據表明,Epigraph-mi3納米顆粒保持了與天然病毒顆粒相當的凝集活性和抗原完整性,且與可溶性Epigraph蛋白相比可能具有更強的抗原性。
Phylogenetic Analysis of H9N2 AIVs and Representa- tive Strain Selection
對H9N2流感病毒HA基因的系統發育分析表明,H9N2流感病毒已演化成多個獨立分支。根據系統發育樹(圖2),H9亞型流感病毒被劃分為四個譜系:h9.1、h9.2、h9.3和h9.4。其中,h9.1和h9.2譜系與1966年北美早期分離株相關。h9.3譜系分布最為廣泛,涵蓋亞洲、歐洲、非洲、太平洋地區和北美。h9.4譜系為最大分支,包括h9.4.1(G1樣譜系)和h9.4.2(BJ94樣譜系),自1994年以來在亞洲多數國家流行。中國境內的H9N2病毒主要屬于h9.4.2譜系,該譜系進一步劃分為h9.4.2.1、h9.4.2.2、h9.4.2.3、h9.4.2.4、h9.4.2.5和h9.4.2.6。2007年以前,中國H9N2病毒主要屬于h9.4.2.1至h9.4.2.4譜系;h9.4.2.6譜系病毒在2010年至2016年間曾短期流行,而h9.4.2.5譜系目前在中國占據主導地位。為評估Epigraph疫苗的交叉反應性,本研究選取了17株具有代表性的H9病毒,分別屬于系統發育樹中的不同譜系(圖2,表S2)。這些毒株的選擇充分反映了H9N2病毒的遺傳多樣性和進化動態,確保了對疫苗廣譜效力的全面評估。
Strong Antibody Responses in Mice
將純化的Epigraph0-mi3、Epigraph1-mi3和Epigraph2-mi3納米顆粒按等摩爾比例混合,配制出Epigraph疫苗。作為對照疫苗的AL/39滅活疫苗,是通過β-丙內酯(BPL)滅活在雞胚中培養的AL/39株病毒,隨后使用蔗糖密度梯度法純化制備而成。為評估Epigraph疫苗的免疫原性,小鼠在第0天通過肌肉注射進行初次免疫,3周后進行加強免疫。每次免疫后2周采集血清樣本用于后續分析(圖3A)。
酶聯免疫吸附試驗(ELISA)結果顯示,AL/39組和Epigraph組均對三種不同的Epigraph蛋白產生了特異性血清免疫球蛋白G(IgG)抗體反應。第二次免疫后,Epigraph疫苗顯著提高了HA特異性IgG抗體的水平。第二次免疫后,Epigraph疫苗顯著提高了HA特異性IgG抗體的水平。值得注意的是,mi3組也引發了適度的IgG抗體反應。
為進一步評估免疫過程中IgG抗體反應的類型,我們分析了IgG亞型。結果顯示,Epigraph免疫小鼠的HA特異性IgG1和IgG2a滴度顯著升高,表明誘導了Th1和Th2免疫反應。此外,在整個免疫過程中,IgG1/IgG2a比值始終大于1,表明以Th2介導的抗體反應為主(圖3B?D)。當針對不同H9N2毒株的HA蛋白進行評估時,與AL/39疫苗相比,Epigraph疫苗在加強免疫后誘導了顯著更高的HA特異性IgG反應(圖3E),表明Epigraph免疫在小鼠中誘導了更強的體液免疫反應。
Robust Cross-Reactive Antibody Response against H9N2 AIVs
為評估交叉反應抗體應答水平,每組6只BALB/c小鼠分別接種上述Epigraph疫苗、AL/39疫苗或mi3納米顆粒制劑。
在初次免疫(圖4B)和加強免疫(圖4C)兩周后,采集小鼠血清樣本。采用17株具有代表性的H9N2病毒株(圖4A)進行血凝抑制試驗。根據世界衛生組織及歐洲藥品委員會標準,HI效價≥1:40被視為具有保護效力,該閾值與感染風險降低約50%具有相關性(文獻33-35)。實驗結果表明,Epigraph疫苗能誘導強烈的交叉反應抗體應答:初次免疫和加強免疫后,分別有52.9%(9/17)和82.4%(14/17)的毒株HI效價≥40。
相比之下,AL/39 滅活疫苗在初次免疫和加強免疫后,分別有 41.2%(7/17)和 64.7%(11/17)的病毒株顯示出 HI 滴度≥40。值得注意的是,Epigraph 疫苗在加強免疫后對目前流行的 h9.4 系 H9N2 病毒誘導了 100%的保護性 HI 抗體反應。
對于目前流行的 H9N2 病毒 h9.4.2.5 譜系,Epigraph 疫苗誘導的 HI 抗體滴度顯著高于 AL/39 疫苗,但安徽/2018 株和湖南/2018 株除外,這兩株與 AL/39 疫苗成分一致或相似。熱圖直觀地展示了 Epigraph 疫苗和 AL/39 疫苗之間廣譜 HI 滴度的差異(圖 4B、C),突出了 Epigraph 疫苗所引發的更優的交叉反應性抗體應答。
Immunization with the Epigraph Vaccine Protects Mice against Lethal Challenge of Heterologous H9N2 AIVs
為評估Epigraph疫苗對H9N2亞型病毒感染的防護效力,本研究采用三株代表性毒株(江蘇/2002、山東/2019和湖南/2018)對免疫小鼠進行攻毒實驗,其中江蘇/2002株屬h9.4.2.1分支,山東/2019和湖南/2018株屬h9.4.2.5分支,攻毒劑量為半數致死量(LD50)的10倍。攻毒后連續14天監測感染臨床癥狀及體重變化,當小鼠體重下降≥25%初始體重時實施人道(圖5A)。如圖5B-D所示,Epigraph疫苗與AL/39疫苗免疫組小鼠僅出現輕微體重下降,且迅速恢復至基線水平,全部存活至實驗結束,防護效力達100%。在江蘇/2002和山東/2019毒株感染組中,AL/39疫苗組小鼠在感染后6天內呈現輕度被毛蓬松及活動量減少,而Epigraph疫苗組小鼠基本未出現被毛蓬松、嗜睡等臨床癥狀。相比之下,PBS或mi3免疫組小鼠表現出顯著體重下降、被毛雜亂、顫抖、食欲減退等癥狀,最終全部死亡或達到人道干預終點。實驗數據證實Epigraph疫苗可誘導針對異源H9N2毒株致死性感染的交叉保護作用。
Immunization with the Epigraph Vaccine Reduces Lung Viral Titers and Pathological Inflammatory after H9N2 Challenge in Mice.
為進一步評估Epigraph疫苗的保護效力,研究團隊于感染后3天(圖5B-D)檢測了肺部病毒載量。結果表明,與PBS組和mi3組相比,Epigraph疫苗顯著降低了肺部病毒滴度。在接種Epigraph疫苗并感染江蘇/2002毒株的實驗組中,感染后3天未檢測到肺部病毒脫落,其肺部病毒清除優于AL/39疫苗組。對于山東/2019毒株感染組,Epigraph疫苗組的病毒滴度雖略低于AL/39疫苗組,但差異未達到統計學顯著性。而在湖南/2018毒株感染組中,Epigraph疫苗的肺部病毒清除效果不及AL/39疫苗組。這一現象可能源于AL/39疫苗組分與湖南/2018毒株病毒具有的序列同源性,其血凝素(HA)蛋白的氨基酸序列相似度達96.75%(附表S2)。
為評估肺部病理學變化,對感染后3天(dpi)采集的肺組織切片進行蘇木精-伊紅(HE)染色。如圖6A所示,所有PBS組和mi3組小鼠肺組織均呈現嚴重的細支氣管炎和支氣管肺炎病理特征,具體表現為肺泡間隔增厚、水腫、間質組織炎性細胞浸潤及終末肺泡結構改變。相比之下,Epigraph疫苗免疫組小鼠僅出現輕微肺損傷,表現為可忽略或輕度細胞浸潤及較輕微炎癥反應。與AL/39疫苗組相比,Epigraph疫苗組肺組織病理學評分顯著降低。肺組織切片的組織病理學評估證實,Epigraph疫苗可提供強效保護作用(圖6B)。上述結果表明,Epigraph疫苗對H9N2病毒攻擊具有高度有效的保護效力。
Partial Protection against H9N2 Challenge Conferred by Passive Serum Transfer in Mice
為評估Epigraph疫苗誘導抗體的保護效力,我們進行了被動血清轉移實驗。實驗組小鼠接種兩劑疫苗后,通過終末采血法收集血清。隨后通過腹腔注射將收集的血清轉移至未免疫小鼠體內(圖7A)。血清轉移24小時后,受體小鼠表現出與供體小鼠相當的IgG抗體滴度,證實抗體轉移成功(圖7B)。隨后用10倍半數致死劑量的江蘇/2002病毒株攻毒受體小鼠,并監測其體重變化與存活率(圖7C、D)。接受mi3或PBS組血清的小鼠均在7日內死亡。Epigraph疫苗組和AL/39疫苗組血清受體小鼠雖出現顯著體重下降,但部分個體在嚴重失重后逐漸恢復。
最終Epigraph疫苗組供體血清受體存活率為33.3%(6例中2例存活),AL/39疫苗組達66.6%(6例中4例存活)。上述數據表明,Epigraph疫苗誘導的血清抗體雖能發揮抗病毒攻擊作用,但尚不足以提供保護。要實現該疫苗的全面保護效力,可能需要細胞免疫等其他免疫機制的關鍵協同作用。Immunization with the Epigraph Vaccine Elicits Robust Antigen-Specific T Cell Responses in Mice. T細胞在流感病毒感染期間的病毒清除過程中起著關鍵作用[36,37]。鑒于被動血清轉移實驗中血清IgG的保護效果有限,我們推測Epigraph疫苗所賦予的保護作用可能部分由細胞免疫反應介導。為評估Epigraph疫苗誘導的抗原特異性T細胞反應,我們在加強免疫兩周后分離了小鼠脾細胞(圖8A)。采用流式細胞術定量分析了CD3+CD4+T細胞與CD3+CD8+T細胞的細胞因子分泌情況,具體門控策略如圖S3所示。實驗結果表明,與AL/39疫苗相比,Epigraph疫苗顯著提高了分泌IL-4、IFN-γ和TNF-α的CD3+CD4+T細胞的數量及比例。CD3+CD4+T細胞同時增加IL-4與IFN-γ分泌的現象表明,該疫苗可同時引發Th1和Th2免疫應答(圖8B,C)。鑒于細胞毒性T淋巴細胞(CTLs)對流感病毒清除至關重要[38],我們還分析了CD3+CD8+T細胞的細胞因子分泌情況。數據顯示Epigraph疫苗顯著增強了CD3+CD8+T細胞的活化,表現為分泌IFN-γ和TNF-α的CD8+T細胞數量及比例均大幅提升(圖8D,E)。這些研究結果證實,Epigraph疫苗在小鼠體內能誘導強烈的免疫原性和強有力的細胞免疫應答。
我們進一步研究了T細胞免疫應答的交叉反應性。在加強免疫兩周后分離小鼠脾細胞,分別采用江蘇/2002、山東/2019和湖南/2018株的純化流感病毒HA1蛋白進行刺激。通過酶聯免疫斑點(ELISpot)實驗檢測T細胞產生的干擾素-γ和白細胞介素-4。如圖9A、B所示,Epigraph疫苗在小鼠接種后能針對所有三株病毒誘導高水平的HA蛋白特異性細胞免疫應答。
該疫苗組分泌IFN-γ/IL-4的細胞數量顯著高于PBS組、mi3組及AL/39疫苗組,與流式細胞術結果一致。值得注意的是,盡管Epigraph疫苗對江蘇/2002株誘導的抗體應答有限(血凝抑制效價檢測結果),但仍能引發顯著的T細胞應答。結合被動血清轉移實驗,這些發現表明Epigraph疫苗對江蘇/2002株致死性攻擊的保護作用主要由細胞免疫介導。
結合被動血清轉移實驗,這些發現表明Epigraph疫苗對江蘇/2002株致死性攻擊的保護作用主要由細胞免疫介導。此外,與AL/39疫苗相比,Epigraph疫苗對湖南/2018株誘導的T細胞應答更為強烈。然而根據血凝抑制效價檢測,Epigraph疫苗誘導的可檢測抗體應答水平相當或相對較弱。這些結果表明Epigraph疫苗能在BALB/c小鼠體內誘導強烈的抗原特異性細胞免疫應答,彰顯其作為H9N2亞型病毒候選疫苗的潛力。
討論
近年來,新型病毒(AIVs)已成為對動物和人類構成重大威脅的病原體。其中,H9N2亞型因其在家禽中的廣泛流行及其直接從家禽傳播至人類的能力而尤為令人關注。此外,H9N2已被證實能夠促進新型重組毒株的出現,這些毒株可感染人類。每年二月,世界衛生組織(WHO)預測北半球即將到來的流感季節中最可能流行的流感毒株,并將此信息提供給疫苗生產商。然而,疫苗的生產和分發在毒株預測后需要約6至8個月。這一漫長的過程為病毒通過抗原漂移進化提供了時間,可能導致變異毒株與所選疫苗毒株匹配不佳。由于流感病毒頻繁的抗原漂移,當前流感疫苗的保護譜仍然有限。因此,亟需改進傳統流感疫苗平臺并開發通用流感疫苗。
選擇合適的抗原表位對于開發通用流感病毒疫苗至關重要。在本研究中,我們評估了一種表位優化的通用納米顆粒疫苗。我們利用Epigraph疫苗設計算法設計了廣泛交叉反應的H9N2 HA抗原,以不同病原體群體中的潛在表位覆蓋。基于納米顆粒的抗原呈遞系統在我們的疫苗設計中也至關重要。近年來,單個顆粒上展示多種抗原的納米顆粒已成為一種有前景的疫苗平臺,顯著增強了對抗原的免疫反應。在我們的系統中,Epigraph疫苗通過mi3納米顆粒平臺遞送,HA抗原展示在mi3表面,類似于天然流感病毒顆粒。適當大小的納米顆粒被樹突狀細胞(DCs)和巨噬細胞有效捕獲和呈遞,從而觸發強烈的抗原特異性免疫反應。盡管缺乏NA抗原,納米顆粒表面展示的多個HA優勢抗原相較于傳統滅活全病毒疫苗具有優勢。未來的疫苗評估策略將考慮納入H9NX亞型病毒。
血凝抑制(HI)滴度是評估流感疫苗效力的標準指標。通常認為HI滴度至少為1:40時,對應人類流感感染風險降低50%,并常被用作“閾值"保護滴度。較高的HI滴度通常與更強的保護作用相關。在本研究中,我們證實Epigraph疫苗誘導了針對17種H9N2 IAV毒株中14種的強烈交叉反應HI抗體滴度。值得注意的是,單劑Epigraph疫苗誘導的針對安徽/2018毒株的抗體滴度與AL/39疫苗相當。此外,Epigraph疫苗在當前流行的H9N2 h9.4.2.5譜系中,針對其他三種人類H9N2毒株(湖北/2019、柬埔寨/2021和香港/2014)誘導的HI抗體滴度顯著高于AL/39疫苗。然而,Epigraph疫苗和AL/39疫苗均未誘導針對歷史毒株(h9.1-h9.3譜系)的HI抗體反應。這可能是由于在H9N2病毒進化過程中,歷史毒株不再流行,導致其表位在整體數據集中罕見。雖然增加Epigraph抗原數量可能覆蓋這些罕見表位,但這種方法會稀釋關鍵抗原決定簇。鑒于歷史毒株重新出現的可能性較低,Epigraph疫苗在提供針對當前流行毒株的廣譜保護以及有效應對H9N2抗原漂移導致的疫苗不匹配問題方面仍然有效。
由于HI滴度長期以來一直是流感疫苗批準的主要依據,大多數商業流感疫苗(如滅活疫苗)旨在誘導強烈的體液免疫反應。然而,針對流感病毒的保護性免疫依賴于體液和細胞免疫反應的密切合作。除了抗體反應外,T細胞在流感防御中起著關鍵作用。有研究表明,T細胞反應在老年人群中與疫苗保護的相關性更好。然而,傳統的商業滅活流感疫苗通常無法誘導強烈的T細胞反應。這一局限性被我們的Epigraph疫苗所解決,其通過T細胞表位覆蓋來賦予更強大的T細胞免疫反應。在本研究中,被動血清轉移實驗顯示,Epigraph疫苗誘導的體液免疫反應提供的保護有限,表明T細胞反應在病毒清除中的關鍵作用。流式細胞術和ELISpot結果證實,Epigraph疫苗誘導了強烈的抗原特異性細胞免疫和針對多種H9N2毒株的交叉反應T細胞反應。與AL/39疫苗相比,Epigraph疫苗免疫小鼠表現出CD4+和CD8+ T淋巴細胞分泌的IFN-γ增強。CD4+ T細胞促進B細胞反應并推動淋巴結和脾臟中病毒特異性CD8+ T細胞的擴增。CD8+ T細胞直接清除感染細胞并抑制病毒復制。值得注意的是,盡管Epigraph疫苗誘導的針對江蘇/2002毒株的HI抗體滴度較低,但其通過強烈的T細胞激活提供了保護。此外,一部分激活的T細胞分化為能夠賦予長期免疫的長壽命記憶T細胞。這些記憶T細胞維持抗原特異性T細胞受體(TCRs)的持續表達,使其能夠迅速識別同源抗原并誘導強烈的二次免疫反應。鑒于此,Epigraph疫苗可能比傳統疫苗提供更的長期保護效力。然而,Epigraph疫苗的持久性仍需進一步系統研究。
值得注意的是,由于疫苗類型不同,Epigraph疫苗與AL/39疫苗之間的直接比較并不等同。盡管如此,我們的初步結果突顯了Epigraph疫苗作為通用疫苗候選者的潛力。鑒于其與當前流行的H9N2譜系毒株的交叉反應性,Epigraph疫苗在緩解年度毒株預測、生產和免疫挑戰方面顯示出前景。此外,作為一種體外偶聯蛋白納米顆粒,Epigraph疫苗可使用標準真核和原核蛋白表達系統快速生產。這使得疫苗能夠高效供應和儲備,便于在疫情爆發前迅速開展全球疫苗接種活動。
材料和方法
Cells, Viruses, and Mice。細胞、病毒與小鼠。HEK293F細胞購自ATCC,并在37°C、85%濕度、5% CO2、120 rpm的搖床培養箱中使用SMM 293-TII表達培養基進行培養。
表位圖抗原的設計與表征。首先,從GISAID公共數據庫中下載了1966年至2022年11月29日期間在中國分離的H9N2(AIVs)的11,367條HA氨基酸完整編碼區序列。去除重復序列和低質量序列后,剩余的6,445條序列使用MAFFT軟件(版本7.505)進行比對。提取HA第1-337位(HA1,HA的球狀頭部結構域)的序列并上傳至Epigraph疫苗設計器。運行參數設置為:表位長度:9,疫苗池中序列數量:3。最終生成了三條HA表位圖序列(Epigraph0、Epigraph1和Epigraph2)。本研究中使用的表位圖及其他蛋白質序列見表S3。將這6445條HA1序列與三條表位圖序列合并,使用MAFFT對每個基因片段進行多重序列比對。使用IQ-Tree2(版本2.2.0.3)在Linux系統下對處理后的比對結果進行最大似然法系統發育樹分析,參數設置為-bb 1000-bnni -m MFP。系統發育樹使用FigTree軟件(版本1.4.3)進行圖形化展示。
質粒構建。表位圖HA基因分別針對人類細胞進行密碼子優化,并由生工生物合成。SpyTag和六組氨酸標簽通過甘氨酸-甘氨酸-甘氨酸-絲氨酸(GGGS)連接子依次融合在表位圖HA的C端,并進一步克隆至哺乳動物表達載體pCAGGS中。SpyCatcher-mi3通過柔性連接子GGS(4)和GGGS連接子分別將SpyCatcher和六組氨酸標簽融合至mi3的N端和C端獲得。隨后將該構建體插入大腸桿菌表達載體pET28a中。
蛋白質表達與純化。表位圖-SpyTag使用真核表達系統進行表達。簡而言之,HEK293F細胞在SMM 293-TII表達培養基(M293TII-1,義翹神州)中于37°C、85%濕度、5% CO2、120 rpm的搖床中培養。當細胞密度達到1.2 × 10^6 cells/mL時,以1:2的比例將質粒與聚乙烯亞胺試劑(23966-100,Polysciences)進行瞬時轉染。孵育5天后,于8000 rpm、4°C離心1小時去除細胞。收集上清液并通過0.22 μm濾膜(SLGP033RB,默克密理博)過濾。過濾后的上清液使用HyPur T Ni-TED 6FF(His-Tag)預裝重力柱(C600801,生工生物)進行純化。目標蛋白使用含有50 mM HEPES,pH 7.4)、300 mM咪唑和300 mM NaCl的緩沖液洗脫。洗脫液濃縮后使用預先用PBS平衡的Superose 6 Increase 10/300 GL柱(Cytiva)進行尺寸排阻色譜進一步純化。蛋白質純度和濃度通過十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE)和BCA蛋白質定量試劑盒(E112-02,Vazyme)測定。
SpyCatcher-mi3納米顆粒(NPs)使用原核表達系統表達,方法如前所述。簡而言之,編碼SpyCatcher-mi3的pET28a表達質粒轉化至大腸桿菌BL21(DE3)細胞中,并在含有卡那霉素的LB固體瓊脂平板上于37°C培養16小時。挑取單菌落接種至10 mL含有卡那霉素的LB培養基中,于37°C、200 rpm搖床中培養16小時。將10 mL培養物全部加入1 L含有卡那霉素的LB培養基中,培養至OD600為0.8。使用0.4 mM異丙基-β-D-硫代半乳糖苷(IPTG)于16°C、150 rpm誘導蛋白表達20小時。為純化SpyCatcher-mi3 NPs,細胞于4000 × g離心10分鐘收集。大腸桿菌細胞重懸于100 mL裂解緩沖液(50 mM HEPES、300 mM NaCl、5 mM MgCl2、20 mM咪唑、50 μg/mL脫氧核糖核酸酶和1 mM苯,pH 8.0)中,并使用高壓細胞破碎儀(Union-Biotech)于600 bar裂解。細胞碎片于30,000 × g、4°C離心1小時去除。上清液通過0.22 μm濾膜過濾,上樣至HyPur T Ni-NTA 6FF(His-Tag)預裝重力柱(C600791,生工生物),并用洗滌緩沖液(50 mM HEPES、300 mM NaCl、300 mM咪唑、0.75% CHAPS,pH 8.0)洗滌。進一步使用預先用緩沖液(50 mM HEPES、300 mM NaCl,pH 8.0)平衡的Superose 6 Increase 10/300 GL尺寸排阻色譜柱進行純化。所有純化蛋白均按照制造商說明使用ToxinEraser內毒素去除試劑盒(L00338,金唯智)去除內毒素。殘留內毒素使用ToxinSensor凝膠凝塊內毒素檢測試劑盒(L00351,金唯智)檢測。
表位圖疫苗的制備。為構建表位圖-mi3 NPs,將15 μM SpyCatcher-mi3與60 μM表位圖-SpyTag(mi3 NPs與表位圖抗原比例為1:4)于4°C孵育過夜進行體外偶聯反應。隨后將混合物高速離心10分鐘去除聚集體。進一步使用預先用50 mM HEPES(pH 7.4)和300 mM NaCl平衡的Superose 6 Increase 10/300 GL柱進行尺寸排阻色譜純化。收集目標蛋白,濃縮后于-80°C保存。表位圖疫苗由三種納米顆粒Epigraph0-mi3、Epigraph1-mi3和Epigraph2-mi3等摩爾比混合而成。
SDS-PAGE。SDS-PAGE分析使用10%凝膠進行,凝膠按照PAGE凝膠快速制備試劑盒(PG112,翌圣生物)說明制備。上樣后,凝膠在SDS電泳緩沖液中于150 V運行50分鐘,隨后用考馬斯亮藍染色。染色1小時后,用Milli-Q水脫色,并使用ChemiDoc XRS成像儀(Bio-Rad)成像。
負染透射電子顯微鏡(TEM)。負染透射電子顯微鏡分析將新鮮純化的蛋白以約50 nM濃度置于輝光放電的碳膜包被的300目銅網上。吸附1分鐘后,用2.0%磷鎢酸(PTA)染色1分鐘并洗滌三次。使用Talos L120C透射電子顯微鏡(賽默飛世爾科技)進行成像。
動態光散射(DLS)。DLS分析使用Zetasizer Nano分析儀(馬爾文帕納科)表征mi3和表位圖-mi3 NPs的尺寸和均一性。簡而言之,純化蛋白于4°C高速離心10分鐘去除聚集體,取200 μL上樣至一次性尺寸比色皿中。使用Zetasizer Nano分析儀測定純化蛋白的顆粒分布,每個樣品分析三次。使用GraphPad Prism 9軟件進一步比較mi3和表位圖-mi3 NPs的數量分布。
差示掃描熒光法(DSF)。使用PSA-16儀器(北京佰司特科技)評估目標蛋白的熱穩定性。樣品稀釋至約1 mg/mL,取20 μL稀釋樣品上樣至石英玻璃管(Cat# LG-002,京佰司特科技)。按照制造商說明進行操作。簡而言之,以1°C/min的升溫速率從30°C線性掃描至100°C,并在330 nm和350 nm波長下測量蛋白熒光強度。熱轉變中點(Tm)由F350/F330熒光比曲線的斜率確定。每個樣品測量三次。使用GraphPad Prism 9軟件繪制一階導數數據。
血凝(HA)和血凝抑制(HI)試驗。對于HA試驗,在96孔微孔板中制備測試樣品的2倍系列稀釋液,每孔混合50 μL磷酸鹽緩沖液(PBS)和50 μL樣品。隨后每孔加入50 μL 1%雞紅細胞,于室溫孵育30分鐘后記錄結果。血凝滴度定義為誘導紅細胞凝集的樣品最高稀釋度。采用血凝抑制試驗(HI assay)測定免疫小鼠血清樣本中的抗體效價,具體操作參照先前文獻所述。簡言之,將血清樣本與3倍體積的受體破壞酶(RDE,Denka Seiken,貨號340122)在37°C下孵育18小時,以消除非特異性抑制。隨后,將混合物在56°C下孵育30分鐘以滅活RDE,并加入6倍體積的PBS,使血清最終稀釋至1:10。將血清與雞紅細胞按20:1的比例在4°C下孵育1小時,離心去除紅細胞以消除非特異性吸附。在96孔微量滴定板中,用PBS對血清進行2倍系列稀釋,每孔加入25 μL血清。隨后,每孔加入25 μL含有4個血凝單位(HAU)的H9N2病毒懸液。將板在室溫下孵育1小時,然后每孔加入50 μL 1%雞紅細胞懸液,繼續在室溫下孵育30分鐘。抑制血凝的最高血清稀釋度即為最終的血凝抑制效價。
ELISA 酶聯免疫吸附測定(ELISA)。文獻64所述方法進行ELISA結合實驗,以評估純化的Epigraph蛋白或Epigraph-mi3納米顆粒與市售H9N2血凝素(HA)特異性抗體的結合能力。簡言之,將純化靶蛋白以1 μg/mL濃度包被于ELISA板(每孔0.1 mL),4℃孵育過夜。以PBST洗滌三次后,加入0.2 mL含1%牛血清白蛋白(Sangon Biotech,A600332)的PBST溶液,37℃封閉2-3小時,再次PBST洗滌三次。隨后加入起始濃度為4 μg/mL的H9N2 HA兔源抗體(Sino Biological,11229-RP02)進行1:4梯度稀釋孵育1小時,PBST洗滌五次后,每孔加入0.1 mL辣根過氧化物酶(HRP)標記的羊抗兔IgG抗體(Abbkine,A21020;1:10,000稀釋),37℃孵育1小時。經五次洗滌后,加入0.1 mL 3,3,5,5′-四甲基聯苯胺(TMB)顯色底物(Solarbio,PR1200),以0.1 mL H?SO?終止反應后測定450 nm吸光度。 小鼠血清抗體檢測采用相同包被、孵育及顯色流程,分別使用HRP標記的羊抗鼠IgG(ProteinTech,SA00001?1)、IgG1(ProteinTech,SA00012?1)或IgG2a(ProteinTech,SA00012?2)抗體(1:10,000稀釋)作為二抗檢測血清樣本中相應抗體水平。
小鼠免疫與組織采集。免疫前將Alum佐劑(77161,Thermo Fisher Scientific)以1:1體積比加入免疫原溶液,孵育30分鐘使抗原有效吸附于佐劑顆粒表面。雌性BALB/c小鼠(6-8周齡,n=6)分別經肌肉注射接種10 μg Epigraph疫苗(含Epigraph-mi3納米顆粒各3.33 μg,總量10 μg)或10 μg AL/39疫苗。初次免疫3周后加強免疫。陰性對照組使用4.55 μg mi3(與Epigraph-mi3納米顆粒等摩爾量)。每次免疫以雙股四頭肌兩點注射(每點50 μL)方式實施。免疫后兩周經眼眶靜脈叢采血收集血清用于免疫效力評估。末次免疫兩周后取脾臟樣本分析細胞免疫應答。
小鼠流感攻毒實驗。采用Reed-Muench法測定各病毒株的50%小鼠致死劑量(LD??)。雌性BALB/c小鼠(6-8周齡,n=10)接種AL/39疫苗、Epigraph疫苗或mi3安慰劑。加強免疫3周后,麻醉小鼠,鼻內接種10 LD??劑量的小鼠適應株A/Chicken/Jiangsu/7/2002、A/chicken/Shandong/005/2019及A/chicken/Hunan/06.22_YYGK5T3-OC/2018(25 μL)。攻毒后第3天處死各組4只小鼠取肺組織,通過TCID??和qPCR測定肺內病毒載量。部分肺葉經4%中性緩沖福爾馬林固定、石蠟包埋切片后,進行蘇木精-伊紅(HE)染色分析。剩余6只小鼠監測2周內體重變化,當體重下降至初始值25%時實施。
血清被動轉移實驗。供體BALB/c小鼠按上述方案免疫,加強免疫3周后收集血清檢測IgG抗體。混合血清經56℃孵育30分鐘滅活后,以每只200 μL劑量腹腔注射至受體小鼠。24小時后經眼眶采血測定IgG滴度,隨后以10 LD??江蘇/2002毒株攻毒,每日監測體重與存活率至14天。
細胞內細胞因子染色與流式細胞術。采用流式細胞術評估免疫小鼠脾臟抗原反應性T細胞。裂解紅細胞后的脾細胞以15 μg/mL Epigraph0/1/2蛋白混合物刺激16小時,加入布雷菲德菌素A繼續孵育10小時。依次進行Fixable Viability Stain 510(564406,BD Biosciences)活力染色、Fc受體封閉(S0B0599,STARTER),以及FITC倉鼠抗鼠CD3ε(553061)、PerCP-Cy5.5大鼠抗鼠CD8α(551162)、BV421大鼠抗鼠CD4(562891)表面標記(4℃避光25分鐘)。固定透化后,采用PE標記大鼠抗鼠IL-4(554435)、PE-Cy7標記大鼠抗鼠IFN-γ(557649)、APC標記大鼠抗鼠TNF(554420)進行胞內染色(4℃避光30分鐘),通過BD LSRFortessa X-20流式細胞儀檢測,FlowJo v10.8.1軟件分析細胞因子特異性T細胞比例。
酶聯免疫斑點(ELISpot)檢測。分離的脾細胞以1×10?/孔密度與1 μg HA1蛋白(江蘇/2002、山東/005/2019或湖南/06.22_YYGK5T3-OC/2018株)在5% CO?、37℃條件下共孵育24小時。依次加入生物素化抗IFN-γ/IL-4抗體(37℃ 1小時)及酶標鏈霉親和素(37℃ 1小時)。陽性對照組加入佛波酯/離子霉素刺激,陰性對照組不處理。采用ImmunoSpot Analyzers自動計數儀檢測斑點形成單位(SFU)。
統計學分析。組間比較采用雙尾t檢驗,多組比較采用單因素方差分析(Tukey多重檢驗)。所有分析通過GraphPad Prism 9軟件完成,顯著性閾值設定為p<0.05。具體統計方法見圖表注釋。
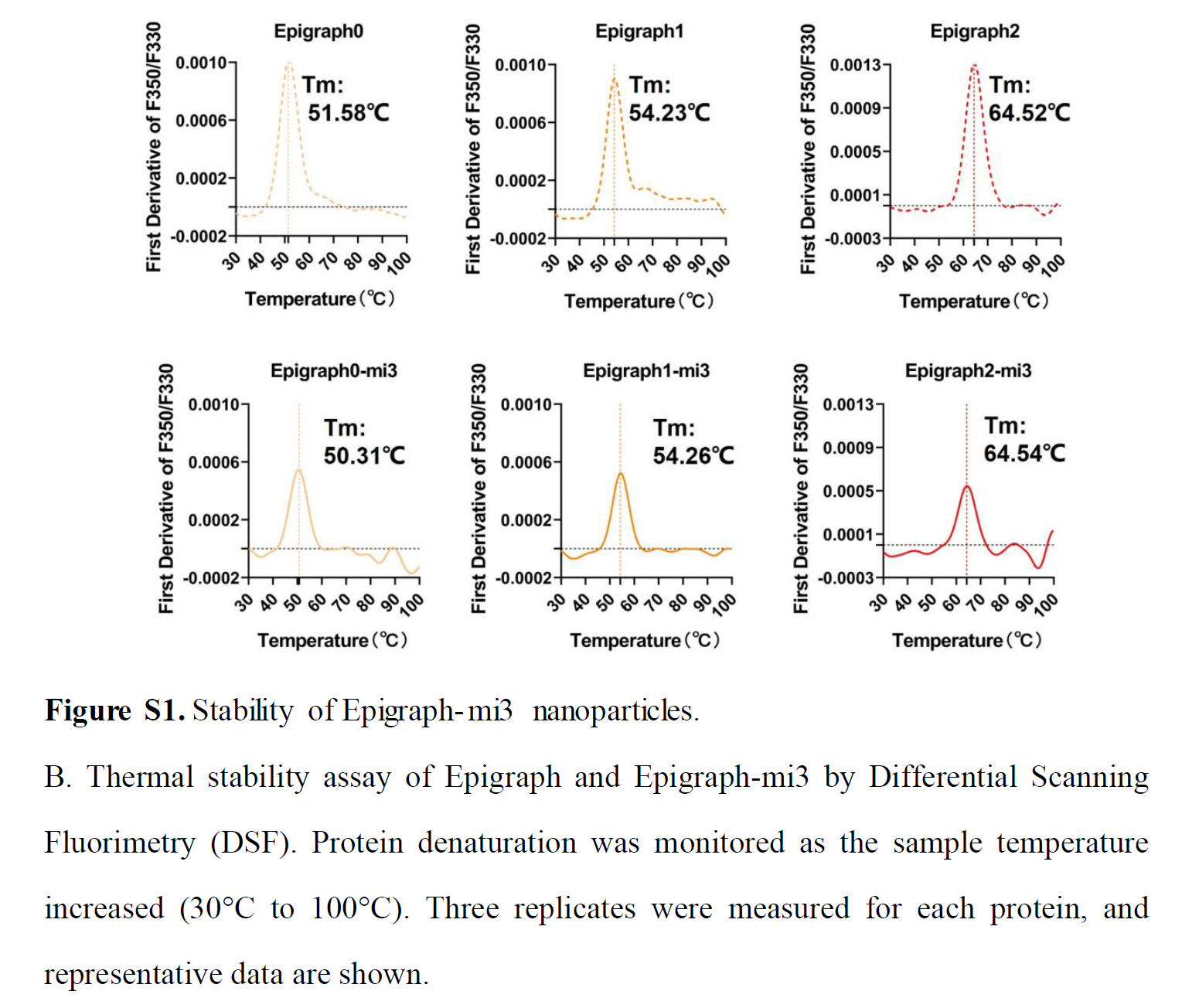
差示掃描熒光法(DSF)。使用PSA-16儀器(北京佰司特科技)評估目標蛋白的熱穩定性。樣品稀釋至約1 mg/mL,取20 μL稀釋樣品上樣至石英玻璃管(Cat# LG-002,京佰司特科技)。按照制造商說明進行操作。簡而言之,以1°C/min的升溫速率從30°C線性掃描至100°C,并在330 nm和350 nm波長下測量蛋白熒光強度。熱變性中點(Tm)由F350/F330熒光比曲線的斜率確定。每個樣品測量三次。使用GraphPad Prism 9軟件繪制一階導數數據。

蛋白穩定性分析儀PSA-16
北京佰司特科技有限責任公司于2023年推出了自主研發的第一款國產的蛋白穩定性分析儀PSA-16。
PSA-16的性能和參數達到進口設備的水平,價格卻遠低于進口產品,彌補了目前國產自主設備在蛋白穩定性研究分析領域的空白。
主要參數★ 測定參數:Tm、Cm、ΔG等;
★ 樣品通量:16個;
★ 樣品體積:≤20 uL;
★ 濃度范圍:0.01-200 mg/ml;
★ 溫控范圍:15-110度;
★ 變溫速度:0.1-15度/分鐘;
★ Tm重復性:CV小于1%;
★ 耗材參數:一次性,無需清洗;
★ 八聯排設計,適配多通道移液器;
多功能蛋白穩定性分析儀PSA-16基于內源差示掃描熒光(ifDSF)技術,廣泛應用于蛋白質穩定性研究、蛋白質類大分子藥物(抗體)優化工程、蛋白質類疾病靶點的藥物小分子篩選和結合力測定等領域,具有快速、準確、高通量等諸多優點。蛋白質中色氨酸/酪氨酸的熒光性質與它們所處的環境息息相關,因此可以通過檢測蛋白內部色氨酸/酪氨酸在加熱或者添加變性劑過程中的熒光變化,測定蛋白質的化學和熱穩定性。
PSA-16采用紫外雙波長檢測技術,可精準測定蛋白質去折疊過程中色氨酸和酪氨酸熒光的變化,獲得蛋白的Tm值和Cm值等數據;測定時無需額外添加染料,不受緩沖液條件的限制且測試的蛋白質樣品濃度范圍非常廣(10 µg/ml - 250 mg/ml),因此可廣泛用于去垢劑環境中的膜蛋白和高濃度抗體制劑的穩定性研究。此外,PSA-16具有非常高的數據采集速度,從而可提供超高分辨率的數據。同時PSA-16一次最多可同時測定16個樣品,通量高;每個樣品僅需要15 uL,樣品用量少,非常適合進行高通量篩選。PSA-16操作簡單,使用后無需清洗,幾乎無維護成本。
多功能蛋白穩定性分析儀PSA-16應用涵蓋植物、生物學、動物科學、動物醫學、微生物學、工業發酵、環境科學、農業基礎、蛋白質工程等多學科領域。蛋白質是最終決定功能的生物分子,其參與和影響著整個生命活動過程。現代分子生物學、環境科學、動醫動科、農業基礎等多種學科研究的很多方向都涉及蛋白質功能研究,以及其下游的各種生物物理、生物化學方法分析,提供穩定的蛋白質樣品是所有蛋白質研究的先決條件。因此多功能蛋白質穩定性分析系統在各學科的研究中都有基礎性意義。
1. 抗體或疫苗制劑、酶制劑的高通量篩選
2. 抗體或疫苗、酶制劑的化學穩定性、長期穩定性評估、等溫穩定性研究等
3. 生物仿制藥相似性研究(Biosimilar Evaluation)
4. 抗體偶聯藥物(ADC)研究
5. 多結構域去折疊特性研究
6. 物理和化學條件強制降解研究
7. 蛋白質變復性研究(復性能力、復性動力學等)
8. 膜蛋白去垢劑篩選,膜蛋白結合配體篩選(Thermal Shift Assay)
9. 基于靶標的高通量小分子藥物篩選(Thermal Shift Assay)
10. 蛋白純化條件快速優化等

